Recent Highlights
Contact us
张文彬课题组
地址:北京市海淀区成府路202号
太阳成集团tyc9728
邮编:100871
电话:010-62766876
电邮:wenbin@pku.edu.cn

请扫以上二维码关注我们课题组的公众号。
我们将定期推送组会每周精读和泛读文献介绍以及课题组的最近新闻!
--------------------------------------------
News
近年来,高效的多肽-蛋白质反应对不断涌现,并因其可基因编码性、高效性以及温和的、细胞相容的反应条件得到了广泛的关注。它可以方便地实现蛋白质之间或蛋白质与合成高分子之间的偶联。其中,又以谍标签-谍捕手反应对为最好,其效率远超同类其他反应对。为了更好地控制其反应性,前期人们已经发展了彼此正交的谍反应对突变体以及超电荷化的谍捕手突变体。在该工作中,张文彬课题组利用GB1蛋白质对于插入其中的谍标签的构象限制作用,发展了对氧化还原敏感的谍标签变体,SpyTagGB1。GB1蛋白具有快速稳定折叠的能力,同时其第二个loop环中可以容忍插入一定长度的氨基酸序列而不影响折叠。基于此,通过在GB1的第二个loop环中插入了反应性的多肽谍标签,得到SpyTagGB1,并在合适位点引入二硫键稳定住GB1的折叠构象,就使得谍标签失去了与谍捕手结合的能力。但是,在还原条件下,二硫键断裂,构象限制不复存在,谍标签将恢复与谍捕手的反应能力,仍然可以与其高效形成异肽键。该工作进一步展示了通过控制氧化还原条件,既可以使用谍反应构建水凝胶,又可以后续在还原条件下引入其他功能蛋白进行凝胶的共价修饰。该工作拓展了多肽-蛋白反应对家族,引入了化学反应性的氧化还原控制,在生物材料以及化学生物学方面具有广泛的应用前景。
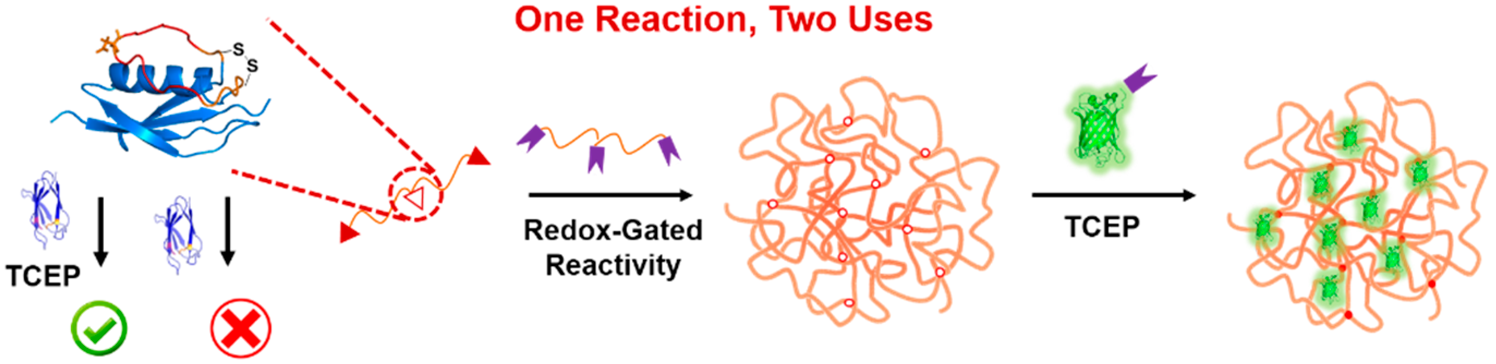
该研究近期发表于ACS Macro Letters(https://pubs.acs.org/doi/abs/10.1021/acsmacrolett.8b00668)。太阳成集团tyc9728博士生吴文豪为该论文第一作者,张文彬研究员为论文通讯作者。该工作得到国家自然科学基金,863计划,青年千人计划和北京大学跨学科医学种子基金的资助。
上一篇: 北京大学张文彬课题组诚聘博士后、科研助理及研发实习生
下一篇: A. James Link教授来访