最新热点
联系我们
张文彬课题组
地址:北京市海淀区成府路202号
太阳成集团tyc9728
邮编:100871
电话:010-62766876
电邮:wenbin@pku.edu.cn

请扫以上二维码关注我们课题组的公众号。
我们将定期推送组会每周精读和泛读文献介绍以及课题组的最近新闻!
--------------------------------------------
新闻中心
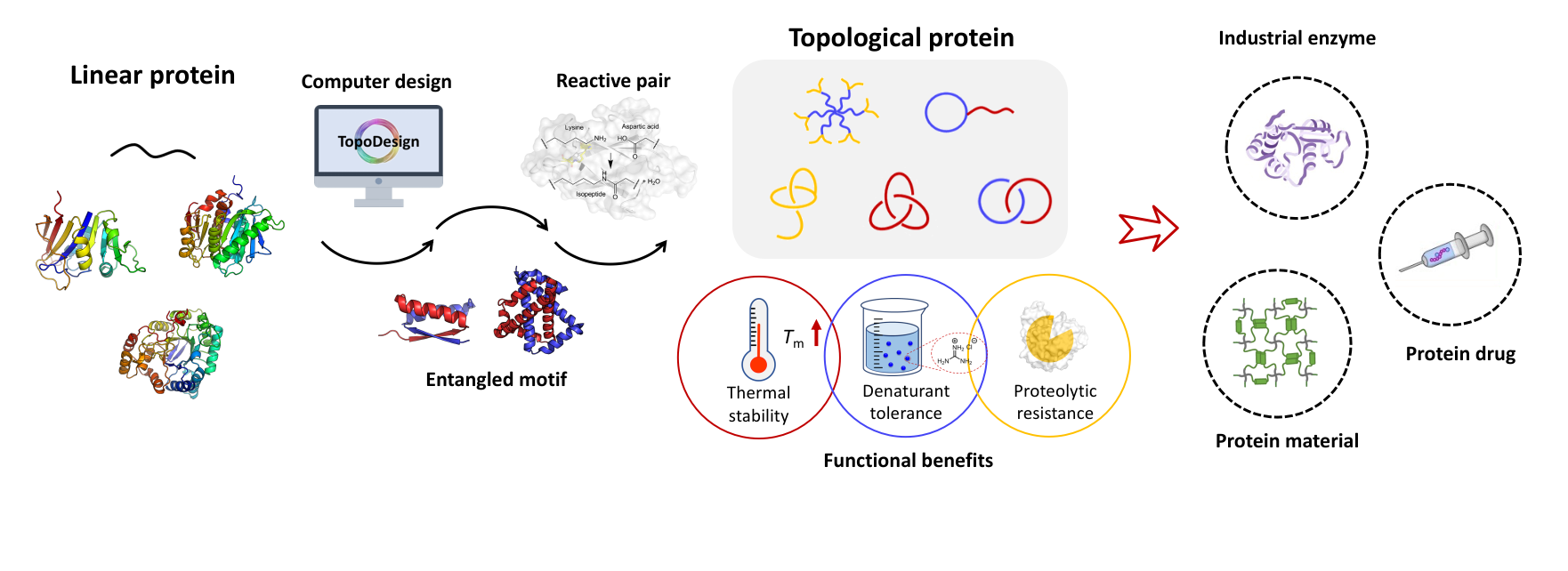
蛋白质是高分子中独特而重要的一类。它可以通过基因编码的手段精确合成,在生命体中发挥丰富的功能。长期以来,生物合成的蛋白质往往是线型主链。尽管非线型主链的拓扑蛋白质有其潜在独特的功能优势,但其设计合成(尤其是单结构域拓扑酶)极为困难。
近期,北京大学张文彬课题组通过对二氢叶酸还原酶(DHFR)的二级结构进行重新接线,利用其天然存在的缠结结构,在不引入外源模板的前提下实现了单结构域二氢叶酸还原酶索烃(cat-DHFR)的胞内直接合成,且无需任何额外的体外反应。通过SDS-PAGE、SEC、LC-MS、IMS-MS及TEV蛋白酶酶解实验等对索烃产物进行表征,并证明了其拓扑结构。与线型对照相比,索烃化产物由于构象限制表现出更好的抗热聚集能力和热回复性。即使在70 ℃下孵育10 min,索烃DHFR仍能保留超过70%的催化活性,而线型对照几乎完全丧失活性。预计该策略同样适用于其他单结构域蛋白质。这将有助于构效关系的探究和阐释。单结构域索烃的设计和合成方法为蛋白质工程提供了全新的对象,并具有更广阔的设计空间和更好的可进化性,在工业酶工程和生物医药等领域具有广泛的应用前景。

图1. 索烃化二氢叶酸还原酶的设计与生物合成。(a) l-DHFR(左)和cat-DHFR(中)的拓扑结构示意图及cat-DHFR的逆合成分析(右);数字及字母分别指代从N端到C端的β折叠和α螺旋,索烃拆分位点位于α螺旋-C和β折叠-5之间;示意图中高亮的线段指代cat-DHFR中产生的新的柔性链;星形指代索烃的环I上可能的环状重排位点,并在该位置融合分离型内含肽;L2指代索烃的环II中新生成的柔性链;(b) cat-DHFR的胞内合成过程示意图,DHFR1进行了环状重排,按照该部分在野生型DHFR中的顺序分别命名为DHFR1-1和DHFR1-2;环I序列中插入TEV蛋白酶识别序列和寡聚甘氨酸柔性链,环II序列中插入组氨酸标签和柔性链(L2)。
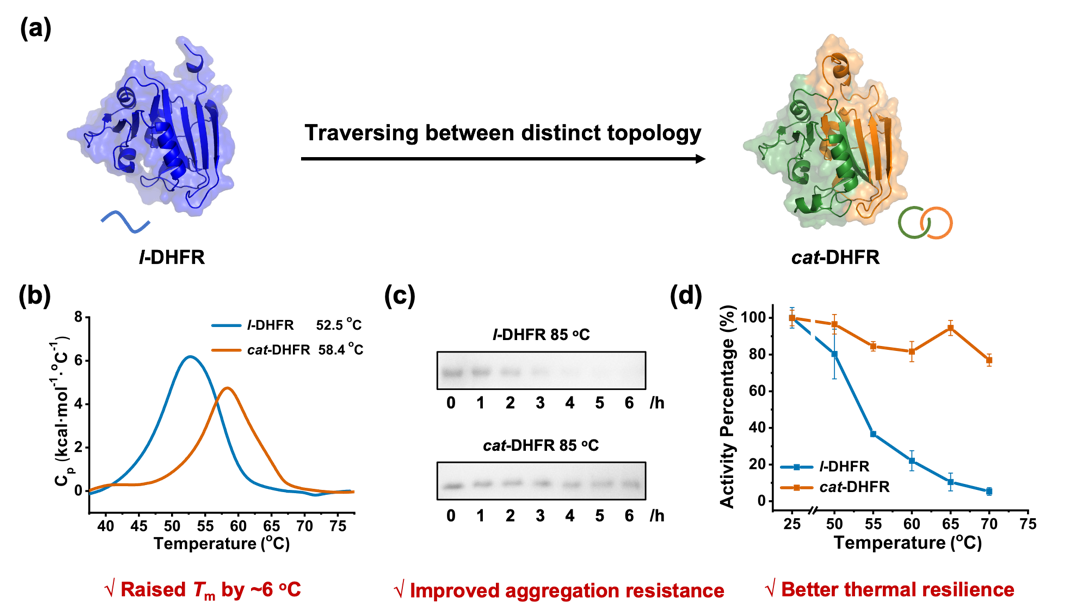
图2.拓扑结构对二氢叶酸还原酶性质的影响。(a) DHFR的拓扑变化示意图;(b) l-DHFR和cat-DHFR的差示扫描量热法表征及其Tm值;(c) l-DHFR和cat-DHFR的抗热聚集性质表征;(d) l-DHFR和cat-DHFR在不同温度下孵育后的酶活性保留情况。
该研究近期在线发表于Natl. Sci. Rev.,太阳成集团tyc9728博士后方晶为第一作者。太阳成集团tyc9728张文彬教授为通讯作者。韩国浦项科技大学Jongcheol Seo教授团队在索烃化二氢叶酸还原酶的拓扑结构表征方面提供了重要帮助。该工作得到国家重点研发计划、国家自然科学基金、北京分子科学国家研究中心项目、韩国国家研究基金委的支持。